2025年4月30日
国立大学法人東海国立大学機構 岐阜大学
がん細胞由来細胞外小胞の標的細胞表面への 結合機構を分子レベルで解明
本研究のポイント
・がん細胞が分泌した細胞外小胞が細胞外マトリックスの一つであるラミニンに結合することで標的の正常細胞に結合することを明らかにしました。
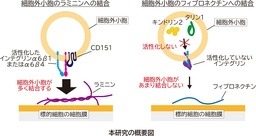
・細胞外小胞上のインテグリンα6β1、α6β4が、CD151の補助により活性化されて、ラミニンへの結合能を担うことを特定しました。一方、細胞形質膜とは違い細胞外小胞では、タリンなどによる細胞質側からのインテグリンの活性化は起こらないことも明らかにしました。
・がん細胞由来の細胞外小胞が血管内皮細胞へ取り込まれた後、この細胞の形態変化を誘導しましたが、内皮細胞表面のラミニンへの細胞外小胞の結合が必須であることを明らかにしました。
・ 細胞外小胞の分子機構の解明により、医学・薬学分野への応用が期待できます。
・【画像:https://kyodonewsprwire.jp/img/202504288057-O4-X1Znz2k2】
研究概要
岐阜大学糖鎖生命コア研究所教授鈴木健一(国立がん研究センター研究所先端バイオイメージング研究分野分野長併任)、岐阜大学連合農学研究科博士課程大学院生磯貝樹らの研究グループは、岐阜大学糖鎖生命コア研究所教授安藤弘宗、同助教河村奈緒子、中部大学生命健康科学部教授古川鋼一との共同研究で、がん細胞が分泌した細胞外小胞が正常な細胞と結合する分子機構を明らかにしました。
近年、細胞間の情報伝達の担い手として、細胞外小胞が注目されています。特に、がん細胞が分泌した細胞外小胞が、がん化していない他臓器の細胞に取り込まれると、その近傍にがん細胞が転移しやすい環境が形成されると言われていて大変ホットな研究対象となっています。しかし、この細胞外小胞が標的細胞に取り込まれる前に、どのように選択的に結合するのか、その機構が明らかではありませんでした。そこで、本研究では、細胞外小胞を1粒子ずつ観察しつつ、標的細胞上の細胞外マトリックスを空間精度21nmで、疑似リアルタイムに超解像動画観察する手法を開発しました。これらの方法により、ラミニンとインテグリンα6β1またはα6β4の結合を介して細胞外小胞が細胞に結合することを明らかにしました。そして、細胞形質膜とは違い細胞外小胞膜内層では、主要なインテグリン活性化分子であるタリン1やキンドリン2が機能せず、膜上のテトラスパニンCD151によりインテグリンが活性化されていることを明らかにしました。また、インテグリンとは別に細胞外小胞中の糖脂質ガングリオシドのGM1がラミニンに結合することを見出しました。また、細胞外小胞とラミニンの結合が、血管内皮細胞の血管新生様の形態変化の誘導に必須であることを明らかにしました。
本研究成果は、日本時間2025年4月30日にJournal of Cell Biology誌で発表されました。
研究背景
細胞外小胞注1は、ほとんど全ての細胞から分泌され、核酸やタンパク質を離れた細胞へと運搬することで、受け手の細胞のふるまいを変化させます。特に、がん細胞が分泌した細胞外小胞は、がん化していない他臓器の細胞に取り込まれると、その近傍にがん細胞が転移しやすい環境を形成させると言われています。そのため、がん細胞由来の細胞外小胞の機能を明らかにすることは、がんの転移機構の解明につながると期待されています。しかし、がん細胞由来の細胞外小胞の標的細胞への分子レベルでの結合機構は、ほとんど分かっていませんでした。
研究成果
本研究では、まず、ガラス上にコートした細胞外マトリックス(ラミニン、フィブロネクチン)注2へのがん細胞由来細胞外小胞の結合能を全反射蛍光顕微鏡を用いた1粒子観察により評価しました。その結果、細胞外小胞は主要な細胞外マトリックスであるフィブロネクチンにはほとんど結合せず、ラミニンに圧倒的に多く結合していました(図1-A)。また、細胞形質膜上のラミニンやフィブロネクチンへの細胞外小胞の結合を高精度に評価するために、我々の研究室で開発した超解像動画観察技術注3を用いて、生きた細胞上の細胞外マトリックスと細胞外小胞の同時観察を行いました。結果、ラミニンに結合する細胞外小胞は頻繁に観察されましたが、フィブロネクチンとの結合はほとんど見られませんでした(図1‐B)。また、細胞外小胞中には、ラミニン、フィブロネクチンの両方の受容体がともに存在するにも関わらず、細胞外小胞の結合に大きな違いがあることを発見しました。
【画像:https://kyodonewsprwire.jp/img/202504288057-O7-XVS3KiEw】
さらに、より頻繁なラミニンへの結合は、異なる4種のがん細胞由来の細胞外小胞で観察され、このことは、いずれの細胞由来の細胞外小胞の粒径によらないことを明らかにしました。
次に、ラミニンへの結合の分子メカニズムを調べるために、細胞外マトリックスの主要な受容体であるインテグリン注4が細胞外小胞上で機能しているかを調べました。それぞれのインテグリンサブユニットを欠損させたがん細胞由来の細胞外小胞のラミニンへの結合能を調べた結果、インテグリンα6、β1、α4を欠損した細胞外小胞では、ラミニンへの結合が著しく減少し(図2‐A)、インテグリンα6β1、α6β4ダイマーが細胞外小胞のラミニンへの結合に関わることを明らかにしました。また、細胞内のタリン1やキンドリン2注5がインテグリンダイマーを活性化することが知られています。そこで、細胞外小胞上のインテグリンダイマーの活性化も同様の機構で起きているか検証しました。結果、タリン1やキンドリン2は、細胞外小胞中でははたらいておらず、細胞形質膜とは違い細胞外小胞膜の内側から外側へのインテグリンの活性化はないことを明らかにしました。一方、ラミニン受容体であるインテグリンダイマーのみを活性化する4回膜貫通タンパク質CD151注6が、ラミニンへの結合活性を向上させることを明らかにしました(図2‐B)。このように、細胞形質膜上とは異なる機構により、細胞外小胞がラミニンに選択的に結合することが明らかになりました(図2‐C)。
【画像:https://kyodonewsprwire.jp/img/202504288057-O6-oC02gALr】
また、細胞外小胞中には糖脂質ガングリオシドGM1注7が、細胞膜中よりも約30倍濃縮されていることを見出しました。興味深いことに、細胞外小胞のラミニン結合において、インテグリンーラミニン間結合に比べると3割程度ですが、GM1―ラミニン間結合も寄与していることを発見しました。一方、他の種類のガングリオシドは、ほぼ寄与しないことも明らかにしました。また、どのガングリオシドもフィブロネクチンには結合しませんでした。
最後に、このラミニンとインテグリンの結合を介して細胞に取り込まれる細胞外小胞がどのような機能を持つかを調べました。がん細胞由来の細胞外小胞が血管内皮細胞(HUVEC注8)に取り込まれることで、この細胞を血管新生様の形態変化を誘導することが報告されています。本研究ではこの細胞外小胞の機能に注目しました。実験の結果、ラミニンを減少させた血管内皮細胞では、細胞外小胞により誘導される形態変化がほとんど起こりませんが(図3)、血管内皮増殖因子VEGFによる刺激ではラミニン減少後も形態変化が起こることが分かりました。そのため、この血管内皮細胞の形態変化自体にラミニンは必須ではありませんが、細胞外小胞とラミニンの結合が、細胞外小胞による形態変化の誘起に必須なことが明らかになりました 。この結果から、ラミニンとインテグリンを介した結合の生理学的な重要性を提示することができました。
【画像:https://kyodonewsprwire.jp/img/202504288057-O8-LXwu3Psd】
今後の展開
本研究により、がん細胞由来の細胞外小胞の標的細胞への結合の詳細な分子機構を解明しました。また、ラミニンを介した細胞外小胞の結合が、内皮細胞の形態変化を誘導することが示されました。がん細胞由来の細胞外小胞上のインテグリンを介した標的細胞表面のラミニンへの結合機構は、臨床応用を含む様々な研究に有用な情報を供与すると考えられ、今後、がんの診断や治療への応用が期待されます。
謝辞
科学技術振興機構CREST (JPMJCR18H2)、国立がん研究センター研究開発費(2023-A-03)、JSPS科研費基盤研究B (JP24K01974)、挑戦的研究(JP24K21944)、2023年度武田科学振興財団研究助成
用語解説
注1 細胞外小胞
様々な細胞から分泌される粒径40~1,000 nmの小胞。miRNAのような核酸やタンパク質などを含み、これらを離れた細胞へ運ぶことで細胞間の情報伝達を媒介する。
注2 細胞外マトリックス
細胞外に存在し、細胞の足場や細胞の形質制御の役割を持つタンパク質群。主要な構成分子として、フィブロネクチン、ラミニン、コラーゲンなどがある。
注3 超解像動画観察
通常の光学顕微鏡が持つ分解能の限界を超えた顕微鏡観察。本研究では高速1分子蛍光観察技術をもとに、当研究室で発展させたdSTORM(直接確率的光学再構築顕微鏡法)超解像「動画」観察技術を用いた。
注4 インテグリン
細胞の接着に関わる細胞膜貫通タンパク質。αサブユニットとβサブユニットを一つずつ含むヘテロダイマーを形成することで、細胞外の様々な分子と結合する。主に細胞外マトリックスの構成分子と結合し、サブユニットの組み合わせに応じて、結合する分子が異なる。
注5 タリンとキンドリン
インテグリンは細胞内外で機能の活性化を受ける。細胞質中のタリンやキンドリンは主要なインテグリン活性化分子であり、インテグリンと細胞骨格との会合体形成やインテグリンを介したシグナル伝達に関わる。
注6 CD151
細胞膜中の4回膜貫通タンパク質、テトラスパニンファミリーの一種。ラミニンの結合に関わるインテグリンα3やα6と相互作用して、インテグリンの機能を活性化する。
注7 ガングリオシドGM1
糖鎖上にシアル酸を1つ以上持つスフィンゴ糖脂質の一種。GM1は1つシアル酸を含んでいて、様々な受容体の活性制御分子として働いたり、コレラ毒素の受容体として知られている。そのため、最もよく研究されていて、脂質ラフトの可視化などにも使用されてきた。
注8 HUVEC
ヒト臍帯静脈内皮細胞。血管内皮細胞の一種で、血管や心臓、リンパ管などの内側を覆っている。内皮細胞研究で最も一般的に使用されている。
論文情報
雑誌名:Journal of Cell Biology
論文タイトル:Extracellular vesicles adhere to cells primarily by interactions of integrins and GM1 with laminin
著者:Tatsuki Isogai, Koichiro M. Hirosawa, Miki Kanno, Ayano Sho, Rinshi S. Kasai, Naoko Komura, Hiromune Ando, Keiko Furukawa, Yuhsuke Ohmi, Koichi Furukawa, Yasunari Yokota, Kenichi G. N. Suzuki
DOI: 10.1083/jcb.202404064

