1.リリースの概要
医療機器ソフトウェア規制の専門コンサルティング Medical Software Consulting(MSC) は、AI時代の医療機器ソフトウェア規制解説動画を、公式 YouTube チャネルにて公開しました。
今回、IEC 62304 / ISO 14971 などの国際規格に加え、米国 FDA が発行している医療機器ソフトウェア系ガイダンスの解説動画5本(医療機器ソフトウェア系3本+AI特有2本)を公開しました。豊富な図表と具体的事例でわかりやすく解説しています。スタートアップ企業、開発エンジニア、RA/QA 担当者が短時間で規制全体像を把握できる構成です。
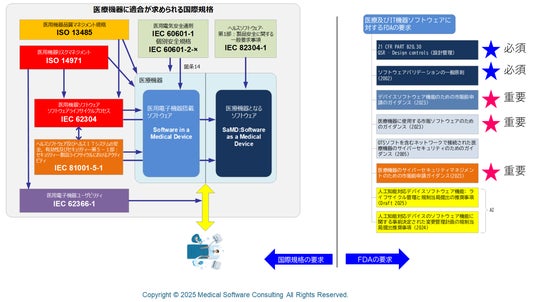
医療機器に適合が必要な国際規格及び FDAガイダンス
【ピックアップ】FDA デバイスソフトウェア機能のための市販前申請のガイダンス
FDAは、2005 年版のガイダンスで規制の対象を医療機器に“含まれる”ソフト全体を対象にし、リスクを Major/Moderate/Minor の 3 段階で評価していました。一方、2023 年版のガイダンスでは規制単位を“機能”ごとに切り分け、提出するドキュメントレベルを BasicとEnhanced の 2 段階に変更しました。これにより、医療機器ソフトウェア市販前ガイダンスのタイトルの用語が“Software”から“Function”に変わりました。規制の対象が デバイスソフトウェア機能(DFS:Device Software Function) となったのです。AIによる診断機能などは AI-DFSとして規制対象となります。これは、これまでハードウェアの内部で単独で機能していた医療機器ソフトウェアが、ネットワーク接続することで、他のシステムやクラウドサービスと連携したり、AIや機械学習による継続更新を管理する必要が出てきたことも規制対象をソフトウェア全体から、ソフトウェア機能に変更した要因のひとつです。
FDAのデバイスソフトウェア機能のための市販前ガイダンスでは、このような背景から医療機器が提供するサービス全体を システム及びソフトウェアアーキテクチャ図を作成して説明することを求めており、ダイアグラムの中で各ソフトウェアコンポーネントの要求仕様をトレースできるようにすることを指示しています。
また、ネットワーク接続する医療機器は、接続先のモバイル機器や、クラウドサービスとどのように連携して医療機器としての機能を提供するのかをシステム及びソフトウェアアーキテクチャ図にてFDAに示す必要があります。
MSCでは、FDAガイダンスの附属書にある システム及びソフトウェアアーキテクチャ図を UMLツール、EnterpriseArchitectにて表記できるようにする設定ファイルを用意しています。この設定ファイルをご要望の方は MSCまでご連絡ください。
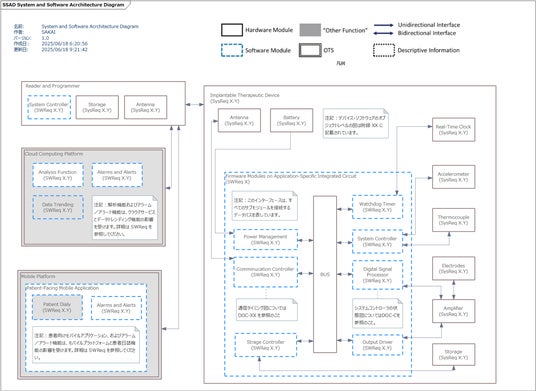
FDAが求めるシステム及びソフトウェアアーキテクチャ図 を UMLツール EnterpriseArchitect で作成した例
【ピックアップ】FDA PCCPガイダンス(AI医療機器ソフトウェアの事前変更計画)
米国では、2018~2024年にAI関連510(k)提出が年平均40%増加しています。トップ3は放射線画像診断、ECG解析、内視鏡支援です。一方、アップデートのたびに追加510(k)/PMA一次変更を要求される旧来の規制では、市販後改良を迅速に届けることが困難でした。さらにAIに特有のデータドリフトやユーザ層の変化による性能低下リスクも顕在化しています。FDAの AI医療機器向けガイダンスはこうした課題に応え、AI 搭載医療機器ソフトウェアの開発者が、将来のアップデート計画を承認と同時に認めてもらう仕組みPCCP(Predetermined Change Control Plan)を世界に先駆けて医療機器規制に取り込んでいます。
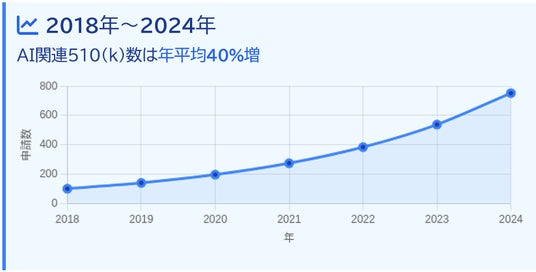
米国のAI関連 医療機器ソフトウェア申請数
一方で国内にはAI医療機器の市販後変更を体系的に扱うルールが未整備で、厚労省/PMDAは変更計画確認手続制度(IDATEN)のQ&Aを改訂し “制度の効果向上” を検討中ですが、AIデバイス専用の運用指針はこれからとなります。
米国FDAは2025年1月にDraft Guidance「Artificial Intelligence-Enabled Device Software Functions: Lifecycle Management」を公表し、承認時にPCCP(医療機器ソフトウェアの事前変更計画)を提出させる仕組みを具体化しました。
FDAは1,000件超のAI/ML医療機器を既に認可しており、市販後のソフト更新ニーズが年々高まっている状況です。
MSC では、今回、これら FDAが公開する AI医療機器ソフトウェア機能に対するガイダンス2本を分かりやすく解説する動画を 公式 YouTube チャネルにて公開しました。日本企業がグローバル競争で出遅れないためには、国内規制が追いつく前にFDA PCCPを先取り学習し、自社開発プロセスへ組み込むことが最短ルートとなります。

FDA PCCPを活用したAI医療機器の改良サイクル

PCCPシナリオを利用した場合の臨床インパクト例
また、MSC は、教育動画とコンサルティングを一体的に提供することで、医療機器開発の 「薬機法対応・ソフトウェア品質・サイバーセキュリティ対応・FDA申請対応」 をトータルに支援しています。
2.解説動画視聴方法
動画は 上記リストの各タイトルをクリックするか、MSC公式 YouTubeチャネルや再生リスト「FDA医療機器ソフトウェアガイダンス解説シリーズ」 から視聴してください。
MSC 医療機器ソフトウェア規制解説動画リスト


3.今後の展開
連載動画:今後も MSC公式 YouYube動画チャネル及び MSCポータルサイトにて医療機器ソフトウェア開発、規格適合に役立つ動画を順次公開していきます。
4.組織概要
事業者名 Medical Software Consulting(MSC)
代表者:酒井 由夫
設立:2025年6月
事業内容:医療機器ソフトウェア規制・サイバーセキュリティに関する教育コンテンツ制作、コンサルティング、QMS 支援。
本件に関するお問い合わせ:info@medical-sc.com
WEBサイト:https://www.medicalsoftwareconsulting.com/
企業プレスリリース詳細へ
PRTIMESトップへ

